Oxydation simple de l'ammoniac en nitrate et nitrite catalysée par le cuivre
Des chercheurs ont montré dans ChemSusChem [1] qu'en utilisant un catalyseur en cuivre dans une solution alcaline, on peut facilement convertir l'ammoniac en nitrate ou en nitrite par un processus électrochimique. Le processus industriel de production de nitrate et de nitrite n'est pas très durable, car il libère du CO2 et du N2O. Le nouveau procédé, plus durable, permet de produire sélectivement du nitrate ou du nitrite par oxydation électrochimique de l'ammoniac.
La méthode traditionnelle
Le nitrite et le nitrate sont des molécules importantes ayant de nombreuses applications biologiques et industrielles, notamment dans le domaine des engrais et des explosifs (nitrate) et dans celui de la prévention de la rouille et de la synthèse pharmaceutique (nitrite). Actuellement, la production de ces substances n'est pas très durable. Le nitrite à grande échelle (NaNO2) est produit en faisant barboter du N2O et du NO gazeux à travers une solution de NaOH et de Na2CO3 en présence d'un catalyseur. Une molécule de CO2 est produite pour chaque deux molécules de nitrite de sodium. Les nitrates (acide nitrique) sont traditionnellement produits par oxydation catalytique de l'ammoniac avec le procédé d'Ostwald à haute température, dont le catalyseur est le platine. Dans ce processus d'Ostwald, entre 0,5 et 2,5% de la production totale est constituée de N2O, qui est un gaz à effet de serre environ 300 fois plus puissant que le CO2 lorsqu'il est présent dans l'atmosphère.
une alternative durable
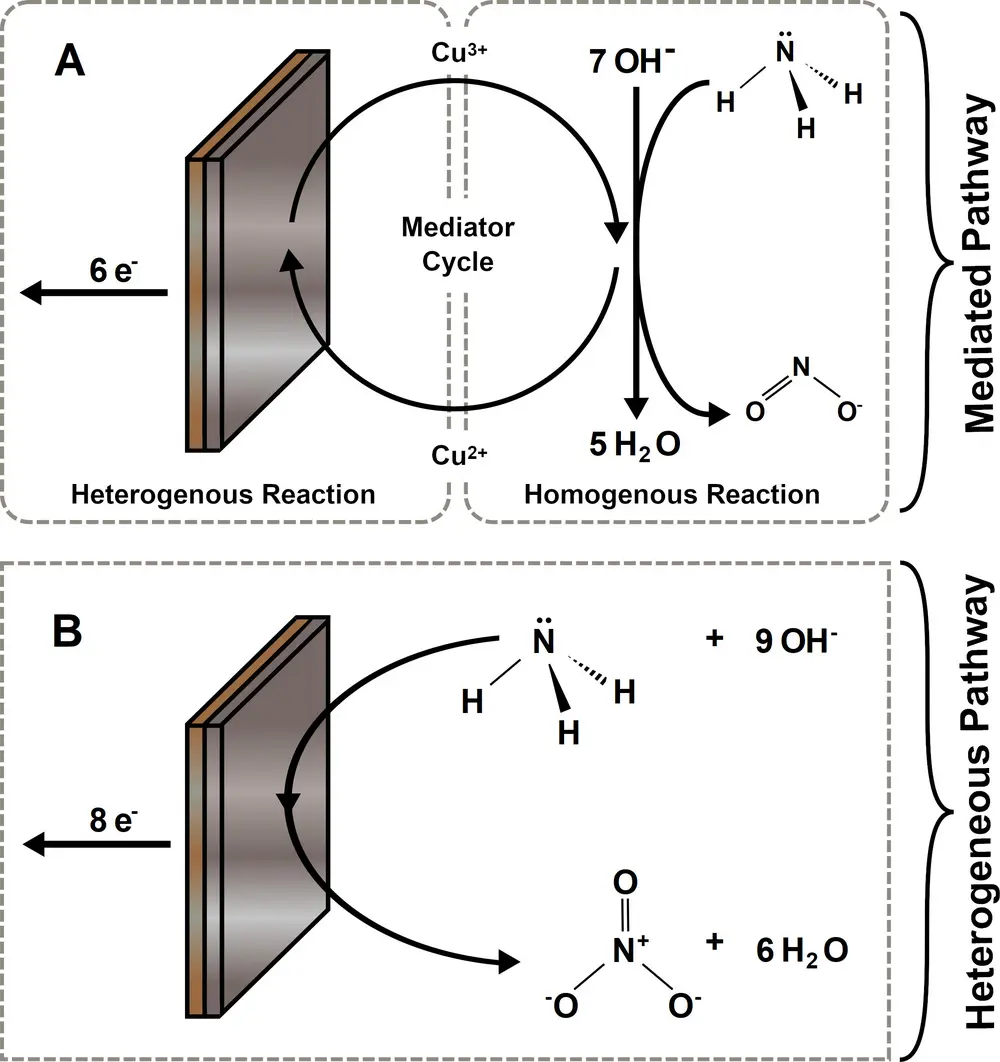
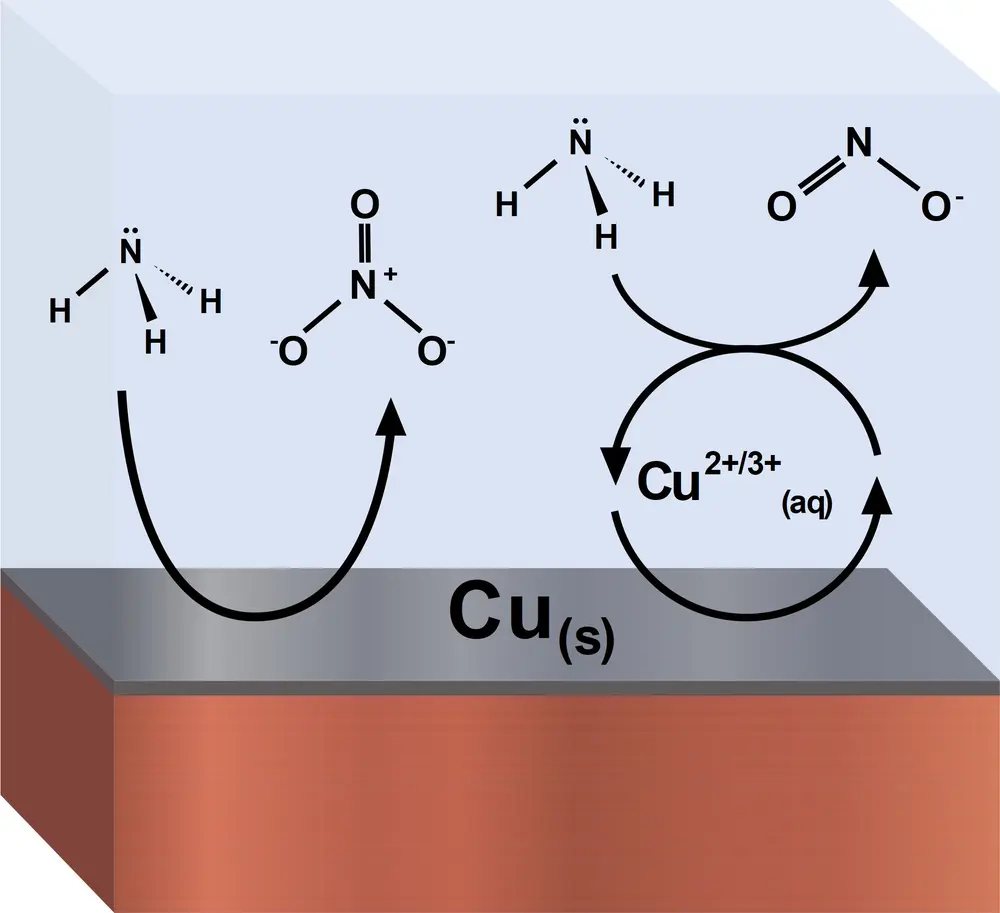
Une alternative durable à ces technologies est l'oxydation électrocatalytique de l'ammoniac avec de l'énergie renouvelable à température ambiante pour la production décentralisée de nitrites ou de nitrates. L'oxydation de l'ammoniac se fait généralement à l'aide de catalyseurs en métal noble. Mais dans la nature, l'enzyme ammoniamono-oxygénase dont le centre actif est le Cu(II) peut oxyder l'ammoniac. Cela a inspiré l'étude [1] du cuivre comme catalyseur, qui a également exploité le fait qu'une partie du cuivre se dissout dans les solutions alcalines avec l'ammoniac. On a découvert que, selon le pH et le potentiel, on peut orienter l'oxydation de l'ammoniac vers la production de nitrates ou, à l'inverse, vers la production de nitrites (voir Figure 1 et Figure 2). Cela se passe dans une cellule électrochimique avec formation de nitrite ou de nitrate à l'anode. L'électrolyte contient du KOH et du NH4OH dissous dans l'eau, et des plaques ou des fils de cuivre constituent les électrodes. Dans l'électrolyte, une catalyse homogène a lieu pour la réaction de formation des nitrites:
NH3 + Cu3+ + 7 OH- → NO2- + Cu2+ + 5 H2O + 5 e-
Cette électrocatalyse homogène au nitrite est soutenue par la transformation redox des molécules de [Cu(OH)4]-/2- qui se dissolvent de l'électrode de cuivre. Le mode stable et continu de cette catalyse homogène a été démontré dans des expériences d'une semaine. Cette électrocatalyse homogène présente une sélectivité élevée et est moins perturbée par l'empoisonnement de l'électrode dû aux intermédiaires "N" fortement absorbés qui polluent le champ d'oxydation électrocatalytique de l'ammoniac.
A l'électrode de cuivre, une catalyse hétérogène a lieu pour la réaction de formation du nitrate:
NH3 + 9 OH- → NO3- + 6 H2O + 8 e-
L'existence de deux mécanismes catalytiques pour l'électro-oxydation de l'ammoniac sur le cuivre a été découverte en étudiant l'effet du pH et du potentiel de l'électrolyte par analyse voltampérométrique et spectroscopie Raman in situ. La sélectivité de l'oxydation de l'ammoniac en nitrite ou en nitrate, catalysée par le cuivre, est obtenue en équilibrant la cinétique des deux mécanismes réactionnels en ajustant le pH de l'électrolyte et le potentiel. Une efficacité Faraday de 86% a été trouvée avec une activité électrocatalytique et une sélectivité élevées pour l'oxydation de l'ammoniac en nitrite ou nitrate dans des solutions alcalines. Cette découverte fournit une base solide pour l'oxydation sélective de l'ammoniac en matière première utile.
Référence
[1] Johnston, Sam, et al. "Copper-catalyzed Electrosynthesis of Nitrite and Nitrate from Ammonia: Tuning the Selectivity via an Interplay between Homogeneous and Heterogeneous Catalysis." ChemSusChem 14.21 (2021): 4793–4801.
