VAN KOOLMONOXIDE NAAR PROPANOL
KOPER helpt OVERTOLLIGE co converteren
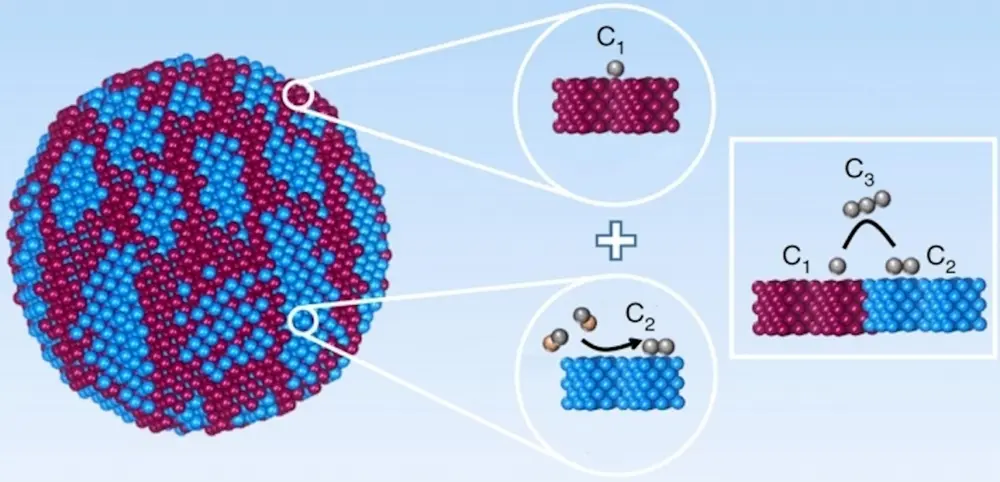
De elektrochemische reductie van koolmonoxide (CO) naar C3-koolwaterstoffen is een veelbelovende manier om dit CO - dat vrijkomt als bijproduct - op te waarderen tot nuttige brandstoffen of chemicaliën. Om koolmonoxide efficiënt zo om te zetten in n-propanol, zijn koperdeeltjes nodig waarvan het oppervlak zo ruw mogelijk is. Hoe meer het koperoppervlak gefragmenteerd is, des te meer n-propanol je krijgt wanneer het potentiaalverschil over de elektrochemische cel daarvoor hoog genoeg is. Andere C3-verbindingen ontstaan niet in aantoonbare hoeveelheden. Hierdoor kunnen koolmonoxideoverschotten bij bijvoorbeeld staalbedrijven nuttig worden omgezet.
WERKINGSMECHANISME
Het is niet de eerste elektrochemische omzetting van CO op een koperkatalysator. Maar dat het redelijke hoeveelheden oplevert van een molecuul met drie koolstofatomen in plaats van een of twee, is wel nieuws [1].
En dat is goed nieuws, omdat n-propanol (Octaan Getal 118) als benzinetoevoeging beter presteert dan de nu gebruikte ethanol. Dat de bestaande katalytische processen soms een beetje n-propanol en andere C3-moleculen opleveren, was al eerder opgemerkt.
Het lijkt een kwestie van toeval: eerst moeten twee CO’s een C2 vormen en vlak daarnaast moet een derde CO worden geadsorbeerd aan het koperoppervlak. Omdat losse CO’s bij voorkeur aan een Cu(111)-kristaloppervlak (Miller indices, [2]) adsorberen en C2 zich dan weer liever vormt op een Cu(100)-oppervlak, ontmoeten die twee elkaar alleen op de randen waar die kristalvlakken in elkaar overgaan. Op een ruw koperoppervlak zijn er meer overgangen van deze kristalvlakken, waardoor er logischerwijs meer n-propanol zou moeten ontstaan.
COMPUTERBEREKENINGEN AAN KOPERNANODEELTJES
Om te beginnen hebben Ted Sargent en David Sinton en promovendi van de University of Toronto computerberekeningen uitgevoerd die dit verhaal bevestigen [3].
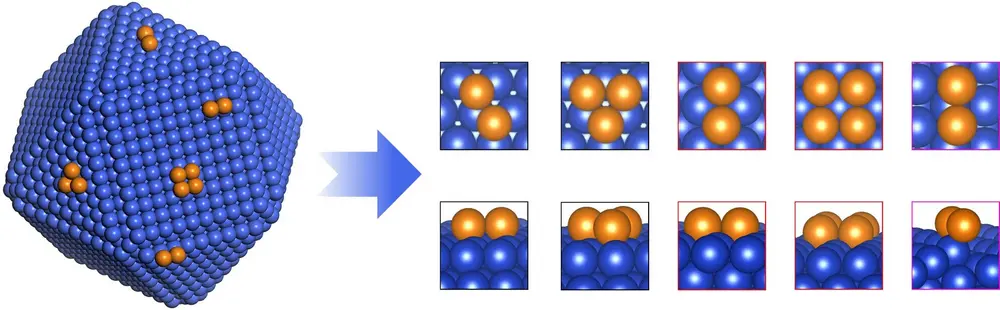
Uitgevoerde density functional theory (dft) berekeningen wijzen uit dat kopernanodeeltjes (‘adparticles’) op een koperoppervlak de CO-bindingsenergie verhogen en de C2-intermediairen stabiliseren, waarmee ze de koppeling van CO en C2-intermediairen mogelijk maken om C3-producten (voornamelijk n-propanol) te vormen. Deze berekeningen tonen ook aan dat de introductie van kopernanodeeltjes op het oppervlak de C3-vorming van n-propanol mogelijk maken door het vergroten van de oppervlaktebedekking door CO, stabilisering van C2 en het verlagen van de energiebarrières naar intermoleculaire C-C-koppeling tussen CO en C2.
De kopernanodeeltjes op Cu(111)- en Cu(211)-oppervlakken tonen een afgenomen reactie-energie voor de *CO-dimerisatiestap met –0,8 en –0,2 eV, respectievelijk vergeleken met de kale 111- en 211-oppervlakken. Bovendien geldt dat, voor het thermodynamisch meest gunstige Cu(111)-oppervlak, de kopernanodeeltjes de adsorptie van *C2-intermediairen (b.v. *OCCOH en *OCCOH) kunnen stabiliseren, vergeleken met het oorspronkelijke Cu(111)-oppervlak (de * geeft aan dat het geadsorbeerd materiaal betreft).
De resultaten tonen verder dat kopernano-deeltjes op de meest voorkomende koperoppervlakken – zijnde Cu(111)-, Cu(100)- en Cu(211)-oppervlakken – essentieel de reactieenergie van een C-C-koppeling van *CO- en *C2-intermediairen (bijvoorbeeld *OCCOH en *CCH2) kunnen verminderen.
De dft-berekeningen bevestigden dat kopernanodeeltjes de reactie-energie verminderden voor het verkrijgen van n-propanol via de CO-reductiereactie (CO-RR).
EXPERIMENTEEL
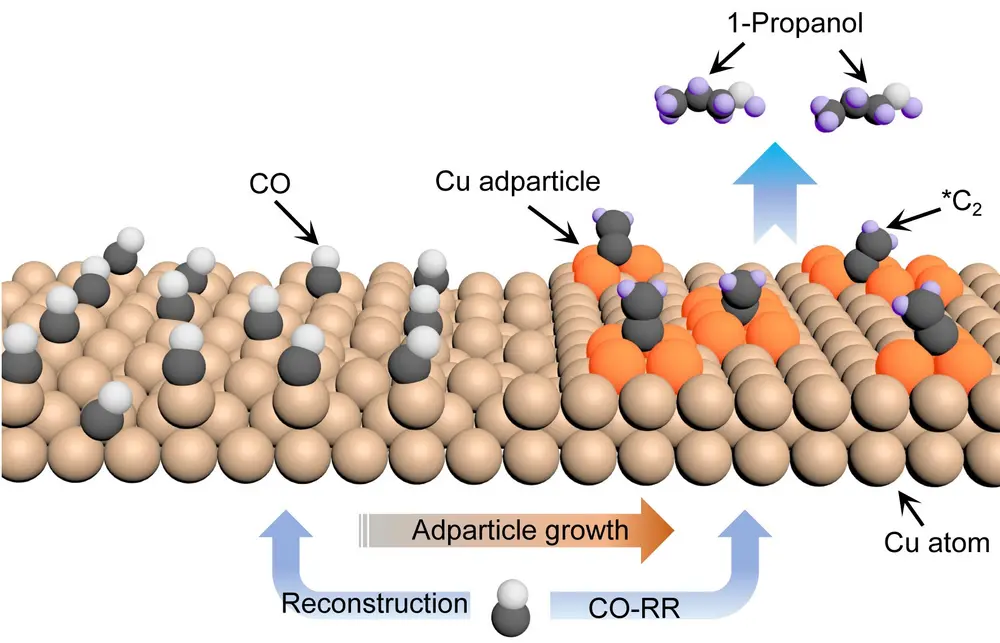
Geïnspireerd door de dft-berekeningen, zochten ze experimenteel verder naar de groei van kopernanodeeltjes en onderzochten ze de impact op de CO-RR-selectiviteit en efficiëntie voor de n-propanolproductie. Hiertoe probeerden ze kopernanodeeltjes te synthetiseren met een zo ruw mogelijk oppervlak, zodat je per definitie een grote verscheidenheid aan kristalvlakken kweekt. Dat deden ze door CuO te laten neerslaan uit een oplossing van CuI. Door de resulterende nanodeeltjes te immobiliseren op een gasdiffusie-elektrode en ze vervolgens de elektrochemische reductie van CO te laten katalyseren in een CO-rijk gas, worden ze allereerst zelf gereduceerd tot metallisch koper a.g.v. een sterke CO-chemisorptie. Door de snelle oxidereductie groeien de nanodeeltjes aan, wat is waargenomen met X-rayabsorptie-spectroscopie. Dat is een kwestie van minuten en onder een elektronenmicroscoop zie je dan het gewenste ruwe oppervlak ontstaan. Een aantal ongecoördineerde plaatsen zoals rand- en hoekatomen zijn aanwezig, die volgens de dft-berekeningen kunnen functioneren als actieve plaatsen voor het katalyseren van de CO-RR-omzetting naar n-propanol.
Met de elektronenmicroscoop werden er kopernanodeeltjes gevonden op de koperachtergrond met een gemiddelde diameter van 3,2 nm. De n-propanolelektrosynthese, gekatalyseerd door gesynthetiseerde kopernanodeeltjes, is hierna inderdaad gemeten. Hoe meer het oppervlak gefragmenteerd is, des te meer n-propanol je krijgt, wanneer het potentiaalverschil over de elektrochemische cel daarvoor hoog genoeg is. De Faraday-efficiëntie is in het beste geval 23% (bij een partiële stroomdichtheid van n-propanol deeltjes van 11 mA cm-2 en een gemiddeld potentiaal van –0,47 V), maar dat is veel meer dan bij eerdere pogingen.
AFHANKELIJKHEDEN
Een verandering van de potentiaal met slechts een paar tienden verandert heel sterk de selectiviteit waarmee je n-propanol maakt. Een grafiek van de n-propanolselectiviteit op kopernanodeeltjes als elektrokatalysator in 1M KOH als functie van de potentiaal heeft een maximum van 23% bij –0,47 V [3].
Een meting van de n-propanolvormingssnelheid als functie van de CO-partiaalspanning laat een eerste ordeafhankelijkheid zien van de n-propanolvormingssnelheid van de CO-partiaalspanning. Ook een afhankelijkheid van de zuurgraad van de productie van n-propanol is te zien. In het gebied tussen 0,5 en 5 M KOH is 1 M KOH het elektrolyt met de hoogste Faraday-efficiëntie voor de vorming van n-propanol. Een verdere verhoging van de KOH-concentratie bevorderde de acetaatvorming veroorzaakt door n-propanol/ethyleenintermediairen in geconcentreerde KOH-oplossingen [3].
KOOLDIOXIDE ALS GRONDSTOF
Nog mooier zou het zijn om kooldioxide in te zetten als grondstof in plaats van koolmonoxide, maar dat maakt de chemie een stuk ingewikkelder en je kunt voor de omzetting van kooldioxide in koolmonoxide beter een afzonderlijk proces nemen, zoals bijvoorbeeld dat waarbij ook chloor wordt geproduceerd uit waterstofchloride. Bovendien is aangetoond dat de tweestapselektrosynthese (van CO2 naar CO en dan van CO naar C2+) beter presteert dan de eenstapselektrosynthese (van CO2 naar C2+), wat gebaseerd is op de prestatie van ieder van de afzonderlijke reacties en de betere efficiëntie van het tweestapsproces [3]. Verder is het toevoegen van CO direct als voeding aan het proces bevorderlijk voor de CO-absorptie op de Cu-katalysator en daardoor potentieel belangrijk voor de productie van hogere koolwaterstoffen, zoals n-propanol.
CONCLUSIE
Kopernanodeeltjes met een hoge dichtheid aan ongecoördineerde atomen kunnen dienen als goede plaatsen voor n-propanolsynthese uit koolmonoxide in een elektrochemische cel. In deze studie [3] leidt de combinatie van dft-computerberekeningen en experimentele resultaten tot een efficiënte uit koper gekatalyseerde, selectieve n-propanolproductie in een elektrochemische cel.
Koolmonoxide komt bijvoorbeeld vrij bij staalfabrieken, die er grote hoeveelheden van over hebben. Eerder presenteerden Tata Steel en Dow Chemical ook al plannen om het te gaan hergebruiken. De hier beschreven methode met de vorming van nanodeeltjes kan in de toekomst wellicht ook worden gebruikt voor het verbeteren van andere metaalkatalysatoren.
Referenties
[1] Arjen Dijkgraaf, Chaotisch koper kweekt propanol, 12 februari 2019,
https://www.c2w.nl/nieuws/chaotisch-koper-kweekt-propanol
[2] Miller indices, https://en.wikipedia.org/wiki/Miller_index
[3] Jun Li et.al., Copper adparticle enabled selective electrosynthesis of n-propanol,
https://www.nature.com/articles/s41467-018-07032-0,
Nature Communications, 2018 november, 5, 9 (1) 4614
