het Omega-Proces onder de loep
Volledig katalytische productie etheenglycol
Het traditionele proces voor de productie van etheenglycol vreet energie en gaat gepaard met dure scheidingsstappen. In 2008 introduceerde Shell het Omega-proces, waarmee de productie van etheenglycol een stuk efficiënter werd.
Achtergrond
Ethyleenglycol - oftewel (etheen)glycol, (CH2OH)2 - wordt geproduceerd uit etheenoxide en water. In de conventionele productie (van Mono Ethyleen Glycol, kortweg MEG) wordt etheenoxide via een opwarming tot ca. 200 ºC omgezet bij een verhoogde druk en met een overmaat water (9:1) - bij te weinig water reageert het gevormde etheenoxide door met etheenglycol en ontstaan er te veel bijproducten (dietheenglycol en trietheenglycol). Door die overmaat water gaat het proces gepaard met een hoog energieverbruik en dure scheidingsstappen. De introductie van het zogeheten Omega-proces van Shell in 2008 bracht daarin verandering. Het Omega-proces (Omega staat voor 'Only MEG Advantage') werd ontwikkeld uit het katalytische proces voor productie van etheenglycol (MEG) van Mitsubishi en het etheenoxide-proces van Shell. Shell verwierf in 2002 de rechten van de technologie van Mitsubishi Chemical en is sindsdien de eigenaar van het geïntegreerde Omega-proces.
Procesbeschrijving Omega-proces
Het Omega-proces bestaat achtereenvolgens uit de oxidatie van etheen tot etheenoxide, de carboxylering van etheenoxide tot etheencarbonaat, en de hydrolyse van etheencarbonaat tot etheenglycol (Figuur 1).
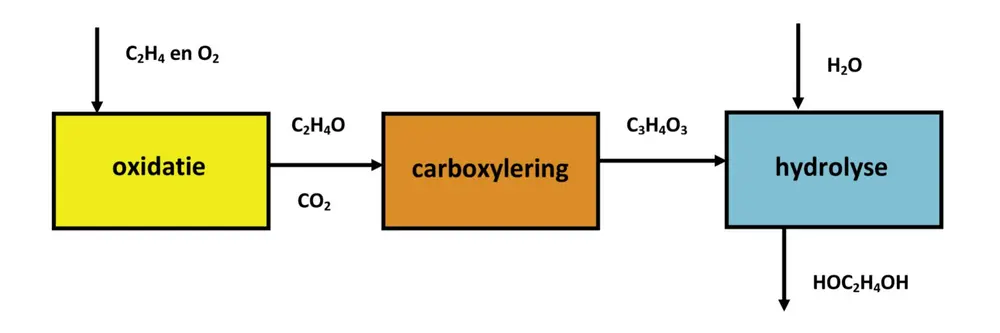
De stappen uit figuur 1 worden hieronder beschreven:
Oxidatie (volledige en onvolledige)
Het proces begint met de productie van etheenoxide (C2H4O) via de oxidatie van etheen met zuurstof over een katalysator die zilver bevat bij temperaturen van ca. 230 tot 270 ºC. De (exotherme) reactie hierbij is:
C2H4 + ½ O2 → C2H4O (∆HR = -104 KJ/mol etheen)
Een klein deeltje van de etheen oxideert volledig naar CO2 volgens de (exotherme) reactie:
C2H4 + 3 O2 → 2 CO2 + 2 H2O (∆HR = -1411 KJ/mol etheen)
Die reactie mag niet te veel plaatsvinden - een ethylchloride-moderator onderdrukt die enigzins. De toch gevormde CO2 wordt verderop in het proces gebruikt bij de carboxylering van etheenoxide.
Carboxylering
De volgende stap in het proces is de reactie van etheenoxide (C2H4O) met opgeloste CO2 tot etheencarbonaat (C3H4O3) volgens de volgende exotherme reactie:
C2H4O + CO2 → C3H4O3 (∆HR = -100,5 KJ/mol)
De CO2 wordt verkregen uit de etheenoxidefabriek (zie hierboven). Bij het opstarten wordt de CO2 echter geleverd uit een vloeibare opslagtank.
Hydrolyse
De laatste stap is de reactie van etheencarbonaat met water, dat in geringe overmaat aanwezig is. Daarbij vindt de vorming plaats van etheenglycol (MEG) volgens de endotherme reactie:
C3H4O3 + H2O → HOC2H4OH + CO2 (∆HR = 8,4 KJ/mol)
De vrijkomende kooldioxide is in te schakelen bij de vorming van etheencarbonaat in de carboxylering. De carboxylering en de hydrolyse vinden plaats in de vloeibare fase, met de inzet van enkele homogene katalysatoren zoals fosfoniumhalide (R3PX2, bv. als Ph3PBr2 (=trifenylfosfoniumbromide)). Na gebruik gebeurt er een recirculatie van de katalysator-oplossing naar de etheencarbonaatreactor. Een kleine spui wordt uit de circulatiestroom van de katalysator genomen, om de accumulatie van zware componenten te voorkomen, zodat er verse katalysator kan worden toegevoegd.
Met het Omega-proces kwam er een eerste volledig katalytische proces voor de productie van etheenglycol uit etheenoxide
Katalysator van de carboxylering en de hydrolyse
Het Omega-proces is het eerste volledige katalytische proces om etheenglycol te maken uit etheenoxide. Omdat de productie van etheenglycol (MEG) daarbij katalytisch verloopt in plaats van via een thermische reactie, verbruikt het proces veel minder water en blijft de vorming van bijproducten beperkt. Het proces combineert een zeer selectieve katalysator voor de conversie van etheen naar etheenoxide met een katalytisch proces om etheenoxide via etheencarbonaat om te zetten in etheenglycol. De omzetting van etheenoxide naar etheencarbonaat heeft het als volgt in de literatuur beschreven reactiemechanisme: Een ‘ylide’ - dit is een reactief intermediair bestaande uit een dipolaire molecule, waarin een negatief geladen atoom (carbanion) rechtstreeks aan een heteroatoom (fosfor) met een positieve lading is gebonden - wordt eerst gevormd uit etheenoxide en een quaternaire fosfoniumhalide katalysator en alkalimetaalzout (bv. K2CO3). Vervolgens reageert dit door met CO2 via een ‘betaïne’ - die heeft in zijn structuur zowel een positieve als een negatieve lading, maar is neutraal en een dipolaire verbinding - als tussenproduct door tot etheencarbonaat. Hierbij komt trifenylfosfine vrij, dat met alkylhalide weer de tetra-alkyl-fosfoniumhalide-katalysator terugvormt.
Volgens een patent van Shell uit 2007 kan de carboxylering/hydrolysestap van etheenoxide nog selectiever richting etheenglycol verlopen (tot 99,7%) met een quaternair fosfonium-halide (zoals tributyl-methyl-fosfoniumjodide) in aanwezigheid van wat molybdaat en een kroonether. Het kroonether kan (naast Fase-transfer-katalysator) goed complexen vormen met fosfoniumhalide. Dit leidt in homogene systemen tot een eenvoudigere scheiding dan bij molybdaatzouten die etheenglycol ongewenst half vast maken. Bovendien is er een betere recirculatie van de katalysator mogelijk.
voordelen Omega-proces
Het Omega-proces voor de productie van etheenglycol (MEG) uit etheenoxide heeft een selectiviteit van 99% - bij de conventionele processen is dat circa 90%. Het proces verloopt op basis van een katalysator (fosfoniumhalides) en vindt niet plaats door een temperatuursverhoging, zoals in het conventionele proces. Zo produceert het proces bijna geen bijproducten (dietheenglycol en trietheenglycol), omdat etheenoxide niet betrokken is bij de hydrolyse. Een behandeling en opslagfaciliteiten voor die bijproducten zijn bijgevolg overbodig. Vooral de scheiding van het watervrije glycolmengsel in het traditionele proces via destillatie naar zuivere etheenglycol, dietheenglycol en trietheenglycol verbruikt veel energie. Het Omega-proces heeft verder een zeer lage consumptie aan etheen per ton geproduceerde etheenglycol (MEG) en kan uit iedere ton etheen 1,95 ton etheenglycol (MEG) produceren, terwijl de conventionele processen tussen de 1,53 tot 1,70 ton produceren. Het proces gebruikt een factor negen minder water, wat leidt tot ongeveer 20% minder stoomverbruik en de productie van ongeveer 30% minder afvalwater dan de traditionele etheenglycol-fabriek met dezelfde capaciteit.
Het Omega-proces gebruikt een factor negen minder water dan het conventionele proces, goed voor ca. 20% minder stoomverbruik en ca. 30% minder afvalwater
Het Omega-proces produceert bovendien veel minder CO2 per ton geproduceerde etheenglycol dan de conventionele processen, omdat er minder energie wordt verbruikt en omdat het proces een selectievere etheenoxide katalysator heeft dan de meeste van de conventionele processen.
Een Omega-fabriek heeft bovendien lagere bouwkosten dan een traditionele fabriek met dezelfde etheenglycol (MEG) opbrengst, zodat er naast milieuvoordelen ook nog economische voordelen zijn. Er is namelijk geen zuivering, opslag en verwerking van dietheenglycol en trietheenglycol meer nodig, wat resulteert in 10% lagere kapitaalinvesteringen en 20% minder benodigde fabrieksruimte.
Commerciële toepassingen
De eerste commerciële fabriek die begon met de toepassing van het Omega-proces werd opgetrokken in mei 2008 in Daesan (Zuid-Korea) - Lotte Daesan Petrochemical plant - en heeft een jaarlijkse capaciteit van 400.000 ton. Een tweede commerciële fabriek kwam er begin 2009 in Saoedi-Arabië (Petro Rabigh), met een capaciteit van 600.000 ton. In het najaar opende Shell een derde fabriek die werkt met het Omega-proces, in Jurong Island in Singapore (Shell Eastern Petrochemicals Complex). Die heeft een capaciteit van 750.000 ton en is een van de grootste in zijn soort.

