CO2 OMZETTEN IN CO via zon EN goudkatalysator
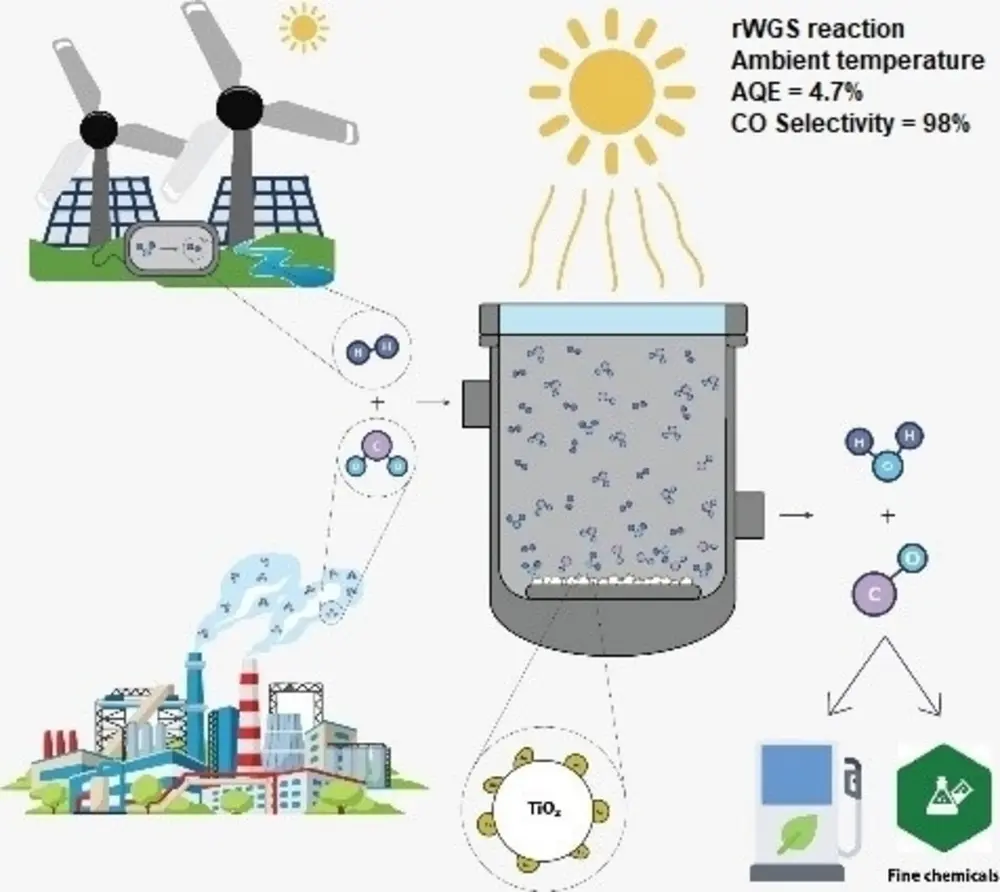
De reductie van CO2 naar CO en dat met Fischer-Tropsch (FT) naar brandstoffen en chemicaliën is een veelbelovende strategie om de koolstofkringloop te sluiten en zo de energietransitie te helpen verwezenlijken. De omzetting van CO2 naar CO zou echter een stuk efficiënter kunnen met behulp van plasmonische goudnanodeeltjes en enigszins geconcentreerd zonlicht. Daarbij behoeft de conversie geen hoge temperaturen. Dat schreven onderzoekers in ChemCatChem [1].
Katalysator met plasmonische goudnanodeeltjes
De onderzoekers begonnen met een katalysator bestaande uit plasmonische goudnanodeeltjes op een drager van titaanoxide, dat zich bevindt in een anataasvorm (een van de drie polymorfen van TiO2). Deze katalysator zet kooldioxide en waterstof selectief om in koolmonoxide en water via een endotherme evenwichtsreactie; de zogeheten omgekeerde water-gasshiftreactie (CO2 + H2 ⇌ CO + H2O).
Bij 30 °C in plaats van 800 °C
Daarbij heeft dit nieuwe proces (zie Figuur 1) een reactortemperatuur van 30 °C (zie Figuur 2), terwijl er normaal 800 °C nodig is. Ook heeft het alsnog een selectiviteit van 98%, dankzij het 'plasmonische' gedeelte. Plasmonische nanodeeltjes kunnen door hun elektronendichtheid een veel groter bereik aan elektromagnetische straling opnemen in vergelijking met het pure metaal.
Plasmonische nanodeeltjes nemen door hun elektronendichtheid een veel groter bereik aan elektromagnetische straling op dan het pure metaal
Zonlichtsimulator en concentrator
De onderzoekers gebruikten een zonlichtsimulator met een concentrator die de intensiteit van het zonlicht tot 14,4 keer de zon verhoogde. Het invallende geconcentreerde zonlicht verhit de katalysatorbodem tot ongeveer 135 °C (zie Figuur 2), mede doordat de nanodeeltjes werken als nano-heaters. De plekken op de katalysator waar de reactie plaatsvindt, krijgen zo de benodigde warmte-energie. Met een selectiviteit van 98% en een CO-productiesnelheid van 429 mmol/h per gram goud (zie Figuur 2) lijkt dit proces een mooi opstapje naar de industrie.
HOGE SELECTIVITEIT
De hoge selectiviteit wordt waarschijnlijk veroorzaakt door ladingsoverdrachtprocessen die de desorptie van de reactieproducten vanaf het katalysatoroppervlak bevorderen. Door de desorptie van water komt er plaats vrij voor nieuwe reactanten en verschuift het reactie-evenwicht meer naar de kant van koolmonoxide. Door de desorptie van koolmonoxide vindt er geen verdere hydrogenering naar methaan plaats.
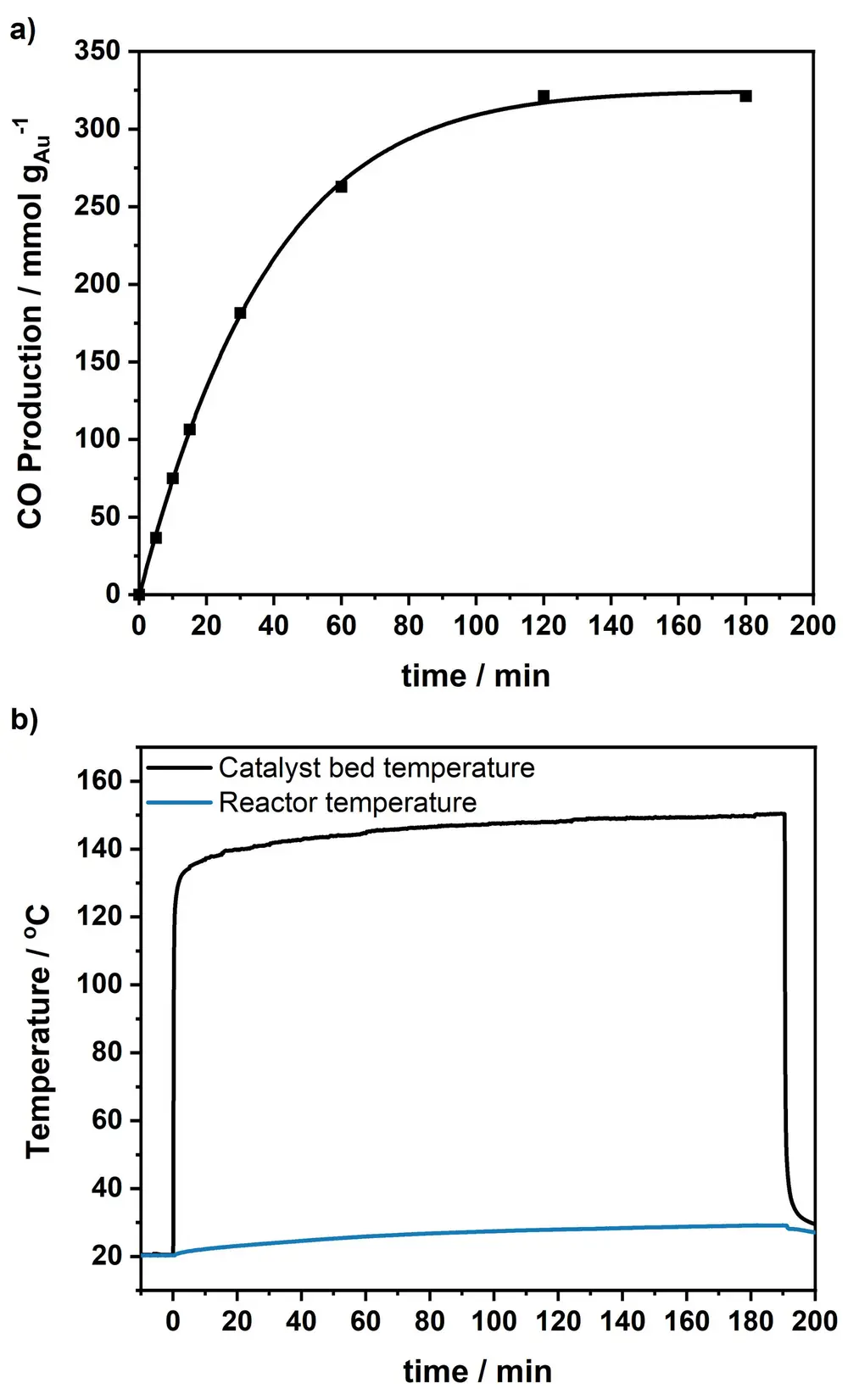
De CO-productie is te zien in Figuur 2. Als het licht wordt aangezet, bereikt de katalysatorbodem een temperatuur van 135 °C (zwarte lijn). De reactortemperatuur bleef daarbij stabiel tussen 20 °C en 30 °C tijdens de drie uur durende reactie (blauwe lijn). Het belangrijkste product was CO met een selectiviteit van 98,2% tijdens de drie uur durende periode en een initiële CO-productiesnelheid van 429,9 mmol gAu-1 h-1 na 15 minuten. Het andere product was CH4. De quantumefficientie was 4,7%, met een CO-eindconcentratie van 4,9% in de batchreactor.
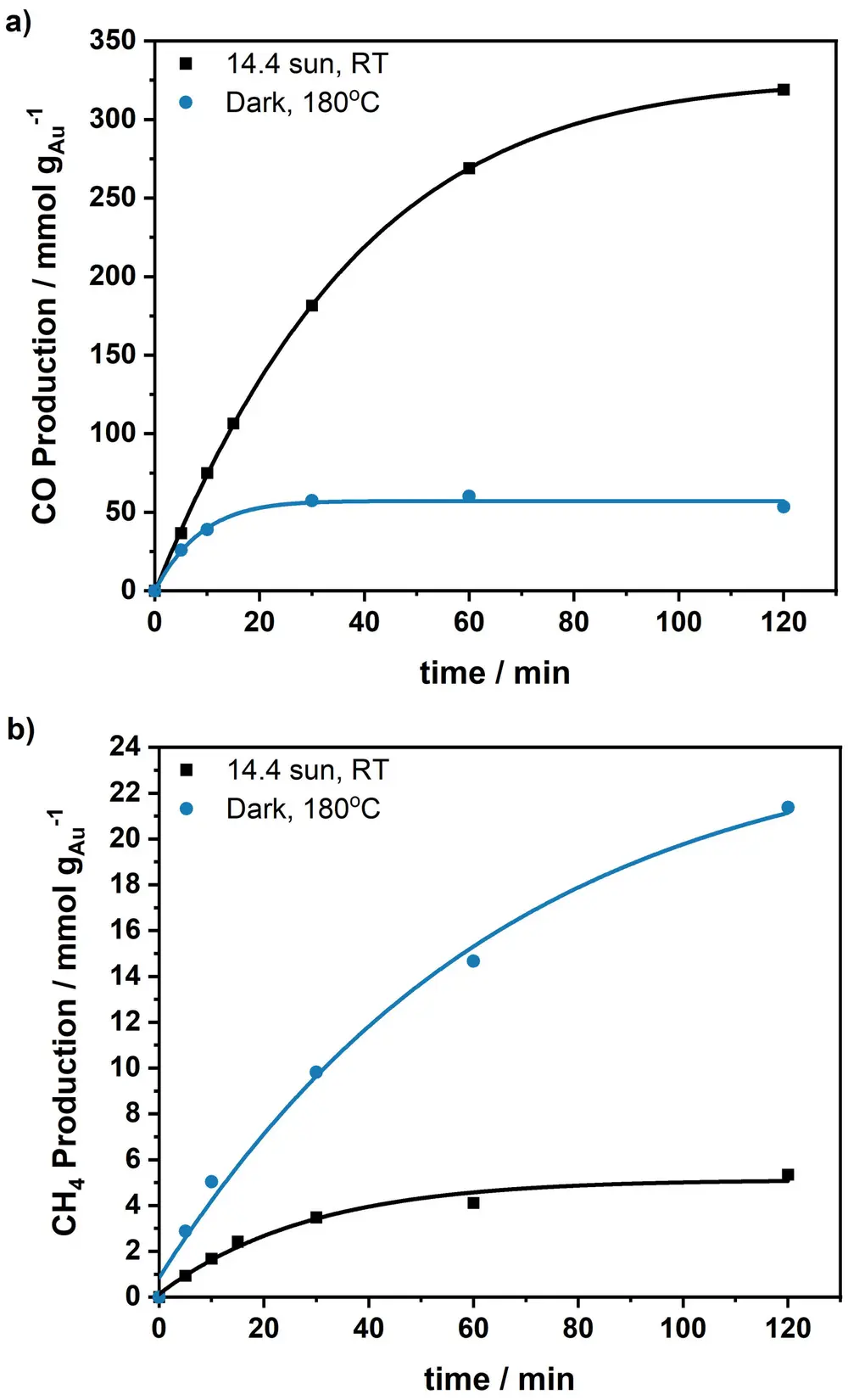
In Figuur 3 is te zien dat in het donker voornamelijk methaan wordt gevormd, terwijl in zonlicht voornamelijk koolmonoxide wordt gevormd. Dit zonlicht wordt geabsorbeerd door de goudnanodeeltjes en niet door de titaanoxidedrager.
Fotothermisch effect
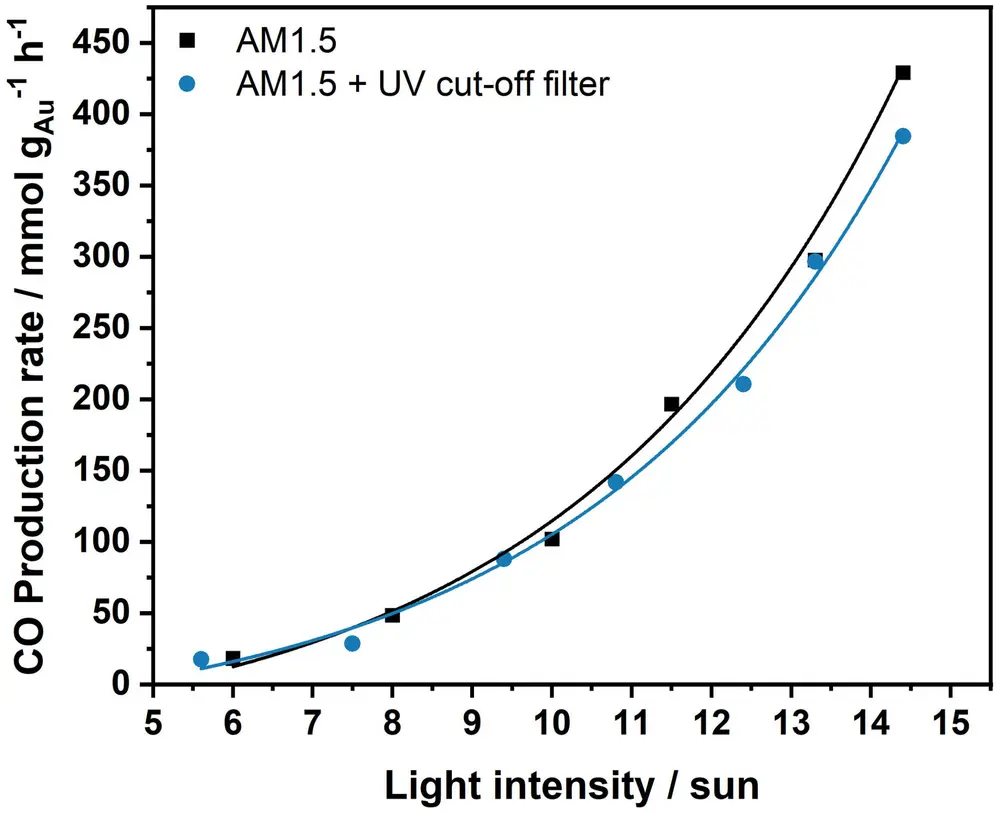
De CO-productiesnelheid toont een exponentiële toename bij een toenemende lichtintensiteit (zie Figuur 4), waaruit blijkt dat het proces voornamelijk wordt bevorderd door een fotothermisch effect. Het geconcentreerde zonlicht kan efficiënt en selectief de omgekeerde water-gasshiftreactie bevorderen zonder een externe opwarming.
Combinatie met Fischer-Tropsch
Het reactieproduct CO is interessant omdat het een bouwsteen is voor de productie van lange koolwaterstoffen door middel van de Fisher-Tropschsynthese. De combinatie van de omgekeerde water-gasshiftreactie en de Fisher-Tropschsynthese is een tweestapsproces dat de potentie heeft om een groene technologie te worden voor de productie van synthetische brandstoffen met CO2 als grondstof.
